| 販売名 |
エルプラット点滴静注液50mg/エルプラット点滴静注液100mg |
| 組 成 |
(1バイアル中) オキサリプラチン 50mg10mL/100mg20mL |
| 薬 効 |
抗悪性腫瘍剤 |
| 長期投与 |
|
| 警 告 |
- 1.
- 本剤を含むがん化学療法は、緊急時に十分対応できる医療施設において、 がん化学療法に十分な知識・経験を持つ医師のもとで、本療法が適切と判断される症例についてのみ実施すること。適応患者の選択にあたっては、各併用薬剤の 添付文書を参照して十分注意すること。また、治療開始に先立ち、患者又はその家族に有効性及び危険性を十分説明し、同意を得てから投与すること。
- 2.
- 本剤投与後数分以内の発疹、そう痒、気管支痙攣、呼吸困難、血圧低下等 を伴うショック、アナフィラキシー様反応が報告されているので、患者の状態を十分に観察し、過敏症状 (気管支痙攣、呼吸困難、血圧低下等) が認められた場合には、本剤の投与を直ちに中止し適切な処置を行うこと。また、回復後は本剤を再投与しないこと (「重要な基本的注意」の項参照)。
- 3.
- 本剤はレボホリナート及びフルオロウラシルの静脈内持続投与法等との併 用の場合に有用性が認められており、用法・用量を遵守すること。また、本併用療法において致死的な転帰に至る重篤な副作用があらわれることがあるので、患 者の状態を十分観察し、異常が認められた場合には、速やかに適切な処置を行うこと。なお、本剤の使用にあたっては、添付文書を熟読のこと。
|
| 禁 忌 |
(次の患者には投与しないこと)
- 1.
- 機能障害を伴う重度の感覚異常又は知覚不全のある患者
[末梢神経症状が増悪するおそれがある。]
- 2.
- 本剤の成分又は他の白金を含む薬剤に対し過敏症の既往歴のある患者
- 3.
- 妊婦又は妊娠している可能性のある婦人 (「妊婦、産婦、授乳婦等への投与」の項参照)
|
| 効能・効果 |
- 治癒切除不能な進行・再発の結腸・直腸癌
- 結腸癌における術後補助化学療法
|
| 効能・効果に関連する使用上の注意 |
1.
- 国内での結腸癌の術後補助化学療法に関する検討は行われていない (「臨床成績」の項参照)。
2.
- 結腸癌の術後補助化学療法においては、臨床試験の投与対象及び病期ごとの結果を熟知し、本剤の有効性及び安全性を十分に理解した上で、適応患者 の選択を行うこと (「臨床成績」の項参照)。
|
| 用法・用量 |
1.
- 治癒切除不能な進行・再発の結腸・直腸癌
他の抗悪性腫瘍剤との併用において、通常成人にはオキサリプラチン85mg/m2(体表面積) を1日1回静脈内に2時間で点滴投与し、少なくとも13日間休薬、又は130mg/m2(体表面積) を1日1回静脈内に2時間で点滴投与し、少なくとも20日間休薬する。これを1サイクルとして投与を繰り返す。なお、患者の状態により適宜減量する。
結腸癌における術後補助化学療法
レボホリナート及びフルオロウラシルの静脈内持続投与法との併用において、通常成人にはオキサリプラチン85mg/m2(体表面 積) を1日1回静脈内に2時間で点滴投与し、少なくとも13日間休薬する。これを1サイクルとして投与を繰り返す。なお、患者の状態により適宜減量する。
2.
- 本剤を5%ブドウ糖注射液に注入し、250~500mLとして、静脈内に点滴投与する。
|
| 用法・用量に関連する使用上の注意 |
- 1.
- 本剤の用法・用量は、「臨床成績」の項の内容を熟知した上で、本剤と併用する他の抗悪性腫瘍剤に応じて選択すること。
- 2.
- 結腸癌の術後補助化学療法において、レボホリナート及びフルオロウラシルの静脈内持続投与法との併用では投与期間が12サイクル、カペシタビンとの併用では8サイクルを超えた場合の有効性及び安全性は確立していない (投与経験がない)。
- 3.
- 国内臨床第I相試験において、単剤では130mg/m2(体表面積) の耐容性が認められているが1)、 本剤を単剤で用いた場合は、その有用性は確立していない (「臨床成績」の項参照)2)。
- 4.
- 国内臨床第I/II相試験において、本剤は、レボホリナート及びフルオロウラシルの急速静脈内投与法での併用療法は、耐容性が認めら れているが、その有用性は確立していない (「臨床成績」の項参照)3)。
- 5.
- 本剤の調製に際しては、配合変化に注意すること。
- (1)
- 本剤は、錯化合物であるので、他の抗悪性腫瘍剤とは混合調製しないこと。
- (2)
- 本剤は塩化物含有溶液により分解するため、生理食塩液等の塩化物を含む輸液との配合を避けること。
- (3)
- 本剤は塩基性溶液により分解するため、塩基性溶液との混和あるいは同じ点滴ラインを用いた同時投与は行わないこと。
- (4)
- 本剤のような白金化合物は、アルミニウムとの接触により分解することが報告されているため、本剤の調製時あるいは投与時にアルミニウ ムが用いられている機器 (注射針等) は使用しないこと。
- 6.
- 米国の添付文書中には、本剤とホリナート及びフルオロウラシルの静脈内持続投与法との併用療法注1)を行う場 合、以下のような投与スケジュール (FOLFOX4法) を2週毎に行うことが推奨されるとの記載がある4)。
- 第1日目
- 別々のバッグから5%ブドウ糖注射液250~500mLに溶解した本剤85mg/m2及 び5%ブドウ糖注射液に溶解したホリナート200mg/m2 注2)を120分かけて同時に点滴静注する。その後フルオロウラシル 400mg/m2を2~4分間で静脈内急速投与し、引き続き5%ブドウ糖注射液500mL (推奨) に溶解したフルオロウラシル600mg/m2を22時間かけて持続静注する。
- 第2日目
- ホリナート200mg/m2 注2)を120分かけて点滴静注し、その後フルオ ロウラシル400mg/m2を2~4分間で静脈内急速投与、引き続き5%ブドウ糖注射液500mL (推奨) に溶解したフルオロウラシル600mg/m2を22時間かけて持続静注する。
- また、米国の添付文書中には、次表の減量基準、投与可能条件の記載がある。
- 減量基準 (前回の投与後に発現した有害事象により判断する)
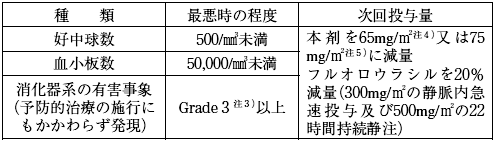
- 投与可能条件 (投与予定日に確認し、当該条件を満たす状態へ回復するまで投与を延期する)

- 注1) 国内において、ホリナート注射剤の「結腸・直腸癌に対するフルオロウラシルの抗腫瘍効果の増強」に関する効能・効果は承認されていない。
注2) レボホリナート100mg/m2に相当する。
注3)「治癒切除不能な進行・再発の結腸・直腸癌」の場合はNCI-CTC version 2.0 (1998年)。「結腸癌における術後補助化学療法」の場合はNCI-CTC version 1 (1982年)。
注4)「治癒切除不能な進行・再発の結腸・直腸癌」の場合。
注5)「結腸癌における術後補助化学療法」の場合。
- 7.
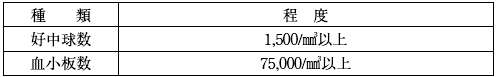
- カペシタビンとの併用療法 (XELOX法) を行う場合には、次の減量基準及び投与可能条件を参考にすること。
- 減量基準

注6) CTCAE version 3.0 (2003年)。
- 投与可能条件 (投与予定日に確認し、当該条件を満たす状態へ回復するまで投与を延期する)
|
| 備 考 |
|



